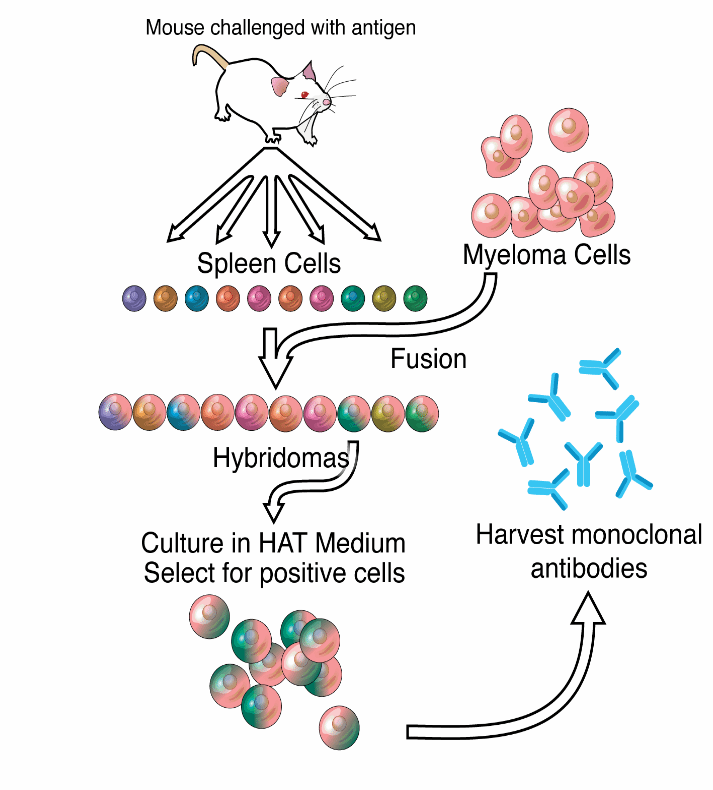
问题1.为什么免疫后没有效价或免疫后效价低?
答:可以从这几个方面去查找原因:
(1)免疫的抗原,分子量和抗原性是否合适;分子量最好不小于25kDa;对于小分子化合物或者多肽,需要偶联载体蛋白,比如KLH,OVA或者KLH,一般首选KLH;
(2)免疫的佐剂是否合适,免疫的佐剂常用的是弗氏完全佐剂与不完全佐剂,可以试试其他的佐剂,比如水溶性佐剂;
(3)免疫程序是否合适,不同佐剂需要设计不同的免疫程序,一般免疫三次后,效价依然没有起色的话,就需要重新考虑目前的抗原设计、抗原和免疫程序问题;
(4)免疫计量问题,蛋白类抗原,免疫之前,通过SDS-PAGE确定蛋白量的问题,比其他蛋白浓度测定方法更靠谱;每种蛋白浓度测定方法都有其缺陷;
(5)免疫方式问题,免疫的时候尽可能多点,多部位,必要的时候可以配合脾脏免疫和尾静脉免疫;
(6)效价测定的问题,测免疫效价,一般采用间接ELISA法,这个方法需要搭建好ELISA测定程序,比如抗原包被的最佳浓度选择,二抗使用浓度,底物灵敏度;另外,对于不同浓度的抗原,对其效价的评价需要区别对待:对于抗原性比较较弱的,1:10000以上就是非常好的选择,对于小分子效价,1:3000也算成功。
问题2:融合后细胞不长或者融合后克隆很少?
最重要的制约因素:血清,融合剂PEG,SP2/0状态,小鼠种系
(1)培养基和血清问题,特别是血清,市面上的血清良莠不齐,不管是什么牌子的,需要亲自做融合测试筛选,筛选到最适合融合培养的,这个工作量有点大,很多人不愿意去做;
(2)融合试剂PEG问题,这个其实是很简单的问题,可以买大牌成品的融合剂,比如Sigma P7181,也可以买大品牌的干粉自己配制,这需要实验室的实验用水比较过关;
(3)免疫所用的Balb/C小鼠,品系是否纯正,如果品系不纯正,即使融合成功,后期在亚克隆过程中,细胞株养不活后者分泌抗体能力越来越弱。
(4)HAT和HT浓度要合适,如果对于HT好HAT试剂组分浓度计算不是特别熟悉或者来源不是特别的纯正的,最好购买商业化的配制好的;自己配制的话要做细胞培养浓度测试,这个实验步骤繁琐。
(5)饲养细胞问题,传统教科书上融合后铺板需要加入饲养细胞,其实如果血清出色,并不需要添加饲养细胞,添加饲养细胞,无形中还增加了污染的可能;我可能用融合专用血清,15%-20%浓度,一个老鼠脾脏细胞与一个T75细胞培养瓶的SP2/0融合,铺板12-15块,根本不用加入饲养细胞,当然这也需要看免疫的脾脏的大小,不同的老鼠和不同免疫抗原免疫出来的脾脏的大小差异还是很大。饲养细胞的作用,是临时提供细胞因子和伴侣支持;
(6)铺板的密度问题,建议每个96孔的板孔铺总细胞数量在100000个左右为宜。
(7)细胞可能被污染。细菌污染很容易观察,培养基很快会变浑浊,培养基变得很黄,真菌污染也很容易判断,支原体污染不容易辨别和发现,可以通过试剂盒检测。
(8)已经问题:培养箱温度,湿度和CO2浓度是否合适;如果不合适,细胞可能不能很好生长;特别是大实验室,培养细胞的人很多共用一个培养箱,反复开关,CO2浓度、温度和湿度都很难保证稳定。
3. 融合后检测不到阳性克隆?
(1) 检测方案是否正确,有没有做平行的阳性对照;
(2) 检测系统与培养液里面的成分干扰了;
(3) 融合的集落太小,分泌的抗体太少;
(4) 长起来的集落是假融合(HAT失活)细胞,或者不正常的集落;
4. 融合后检测是满板的阳性?
(1)建立有效的检测方法,上文已经提及,检测时同时设置平行的阴阳性对照孔;
(2)培养基富营养化,未融合的细胞存活时间太长,分泌大量阳性抗体在孔里;解决方案:置换培养液之后再次检测;
(3)每个细胞板孔细胞集落太多,解决方案:稀释转板培养之后,等生长起来再次检测;
5.融合后的细胞生长很慢?
(1)培养液,特别是血清不太适合细胞生长;一定要选用优质适合杂交瘤生长的血清;
(2)培养耗材对细胞生长不太友好;
(3)细胞量比较少的时候,比如亚克的时候,可以适当添加饲养细胞或者杂交瘤克隆生长因子;
(4)细胞存在污染,比如支原体污染,有的甚至导致细胞死亡;
(5)确实有个别细胞对于营养的需求比较特殊,不容易生长或者生长缓慢,但是分泌抗体能力很强,一个孔里有几个细胞就检测到超强的信号。
6. 经过几轮亚克,阳性的克隆变成阴性?
(1)细胞株不纯,不分泌的细胞占据优势,亚克隆的过程中,阳性细胞没有分种到细胞孔里,或者及时分种到了,克隆没有长起来,自然没有筛选到阳性克隆;
(2)细胞株不稳定,容易发生染色体丢失;所以再细胞传代的过程中需要经常做一下亚克隆;
(3)细胞生长的环境不友好,比如,把细胞培养老了,半死不活的再救回来,可能很多细胞已经变性了;
(4)细胞被污染了,也很容易不再分泌抗体,最典型的就是支原体污染;
7. 为什么亚克隆长不出克隆?
(1)培养基不给力,加点杂交瘤细胞生长因子加入适量的饲养细胞(每孔100000个)
(2)用于亚克隆的母细胞状态不好;
(3)亚克隆时,细胞计数不准或者计算错误;
(4)细胞被污染了,最典型的就是支原体污染;
(5)使用HAT培养的细胞,在亚克隆时候培养液里要添加HT,原因是上一步骤HAT中的A残留,如果不添加HT,会使细胞致死;
(6)其他的硬件问题,与上面的内容相同。
8. 杂交瘤注射到小鼠腹腔不产腹水,只长实体瘤或者产生的腹水没有效价?
(1)小鼠种系不纯,容易不产腹水或者产生的腹水没有效价
(2)致敏剂不太好,或者使用量不够,每只老鼠可以打0.6-0.8ml,隔一周再打一次,两次致敏以后,再注射杂交瘤细胞;
(3)注射腹腔内的细胞量不够,每次每只老鼠注射10^5-10^6个细胞,用灭菌的PBS或者不完全培养基悬浮,体积0.5-1ml
(4)产生过多实体瘤的原因,可能是在主色的时候,刺伤了腹腔皮下或肌肉或者肠道,没有将细胞充分注射到腹腔内;手法很重要;
(5)杂交瘤所产生的抗体与小鼠体内的某个分子特异性结合,产生的抗体被中和,这类抗体针对的靶蛋白与小鼠自身的蛋白物质序列高度同源。
9. 杂交瘤细胞冻存复苏不活?
(1)培养液的配方和关键试剂血清和DMSO,DMSO一定要选择适合细胞培养级别的;配方含有10% DMSO,冻存液至少含有10%-50%的血清;
(2)细胞本身的原因,让细胞处于最佳状态,对数生长时期,细胞数量10^6/ml的浓度比较合适;
(3)冻存的过程中,梯度降温很重要;最简单的方法,将细胞冻存管裹在厚厚的棉花里,埋在干冰里,或者塞在液氮罐的气相过夜,第二天放到液氮里,我们用这个方法从来没有失手。
(4)解冻的过程中,调一大烧杯的热水,热水的稳定稍微高一点,41℃-42℃,不停的搅动,直到完全解冻,吸取冻存的细胞,转入到15ml离心管,再补满不完全培养基,混匀,离心,弃掉上清。细胞沉淀用完全培养基重选培养。
(5)细胞冻存的液氮罐,定期维护,补加液氮,不要液面太低或者液氮挥发完了、
10.细胞污染的挽救
细胞的污染大致可以分三类:细菌污染、真菌污染和支原体污染,还可能由不明微生物污染。
(1)细菌污染,可以加大抗生素浓度,将细胞稀释培养,抗生素浓度加到原来10倍,每隔12小时换液,反复几次;
(2)真菌污染的话,从两种抗生素加到三种抗生素比如,我们常用的抗生素是链霉素和青霉素,可以再加一个两性霉素B,或者制霉菌素;将细胞稀释培养,多次换液,坚持培养一周。
(3)支原体污染,如果轻度污染,可以试试使用60 ug/ml的泰乐菌素和10 ug/ml左右的环丙沙星交替处理;我们还新研发的支原体处理试剂,效果比较好,也是稀释培养,多次换液,坚持培养一周。
(4)利用动物免疫系统清除,将污染的细胞注射到小鼠背部或者腹腔,等实体瘤快长成的时候,再无菌超净台上取下实体瘤,再次培养。